VRAC/LRRC8 Chlorid-Kanäle spielen nicht nur eine entscheidende Rolle im transport von Zytostatika, Aminosäuren und Neurotransmittern. Sie können auch den transport der wichtige Botenstoff cGAMP von Zelle zu Zelle und damit zur Stärkung der Immunantwort auf Infektionen mit DNA-Viren. Dies hat sich nun gezeigt, von Prof. Thomas Jentsch, die ursprünglich entdeckt LRRC8/VRAC-Kanäle und arbeitet am Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) und des Max-Delbrück-Centrum für Molekulare Medizin (MDC) in Berlin, gemeinsam mit Kollegen aus Shanghai unter der Leitung von Prof. Hui Xiao. Da cGAMP wird immer gebildet, wenn die Zellen erkennen die DNA außerhalb Ihrer Kern der Entdeckung ist potenziell von großer Bedeutung für andere Krankheiten wie Krebs. Das Werk wurde inzwischen veröffentlicht in der Fachzeitschrift Immunity.
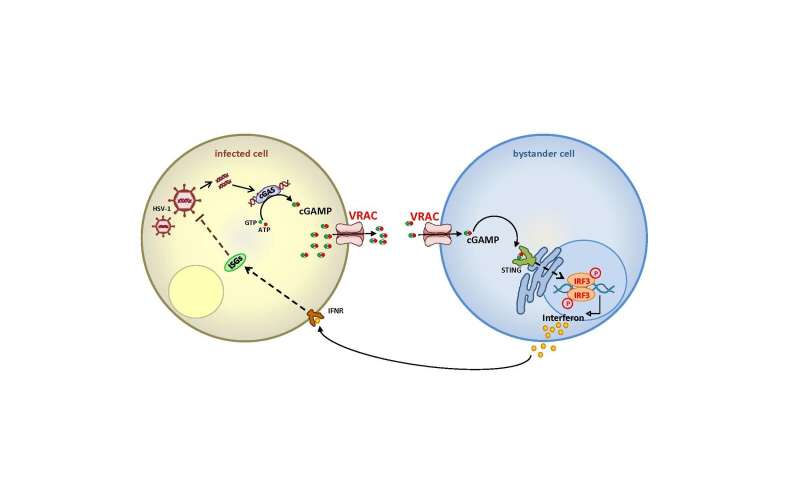
Wenn DNA-Viren wie herpes-simplex-infizieren menschlichen Zellen, es bleibt nicht unbemerkt. In das Zellinnere, das so genannte Zytoplasma, DNA-keinen Platz hat. Daher, wenn DNA erkannt wird es, Botenstoffe bilden und beginnen, alarm zu schlagen. Die Fremd-DNA bindet an das Enzym cGAS, die synthetisiert die ’second messenger‘ cGAMP. Durch Bindung an einen rezeptor namens STING, cGAMP aktiviert die zelluläre Signalkaskade, die ausgelöst wird die Produktion von Interferonen und anderen Faktoren des angeborenen Immunsystems. Dieser Mechanismus wurde auch beobachtet, die in tumor-Zellen, in denen DNA-Fragmente freigesetzt werden aus dem Zellkern in das Zytoplasma, als auch in einigen bakteriellen Infektionen.
cGAMP ist ein hochaktuelles Botenstoff
Forschung auf cGAMP in den letzten Jahren explodiert, zum Teil, weil es wirkt nicht nur in der Zelle, wo es produziert wird, sondern geht auch auf andere Zellen. Unklar bleibt jedoch, wie dies passiert. In den Zellen, die direkt miteinander in Kontakt, cGAMP passieren kann, Zell-Verbindungs-Kanäle bekannt als gap junctions. Aber was ist mit Zellen, die nicht in der unmittelbaren Umgebung?
Forscher unter der Leitung von Prof. Hui Xiao vom Institut Pasteur in Shanghai hatte den Verdacht, dass weitere Transportwege müssen eine Rolle spielen, und kam über die volume-regulated anion channel VRAC—der Ionenkanal entdeckt, der im Jahr 2014 durch Prof. Thomas Jentsch und sein team, die parallel von Prof. Zhaozhu Qiu (jetzt an der Johns Hopkins University), wer trug auch die Veröffentlichung in Immunity. Gemeinsam das Deutsch-chinesische Forschungs-team war in der Lage zu zeigen, mit einer Vielfalt von Methoden, die VRAC-Transporte cGAMP sowohl aus der produzierenden Zelle und in der Empfänger-Zelle. Dies führt zu der Produktion von Interferonen in Zellen, die nicht infiziert sind, und stärken damit die Immunabwehr.
„Wir wissen jetzt, dass VRAC definitiv Transporte cGAMP“, sagt Thomas Jentsch. „Wir wussten nicht, diese Funktion noch, aber es passt gut zu unseren bisherigen Erkenntnissen über VRAC, nämlich, dass es nicht nur Transporte von Chlorid, aber auch andere kleine organische Moleküle, zum Beispiel, Neurotransmitter, Aminosäuren und Zytostatika. Die Abhängigkeit der cGAMP-transport auf die Untereinheit LRRC8E—VRAC ist immer aus mehreren Untereinheiten, stimmt gut mit unseren früheren befunden, die zeigten, dass diese Untereinheit unterstützt den transport von Glutamat, das ebenfalls negativ geladen.“
Die Aufnahme des botenstoffes durch VRAC wurde verifiziert durch Zellkultur-Experimente und durch elektrophysiologische Ansätze. In einem experiment, zum Beispiel, Zellen wurden infiziert mit einem DNA-virus und getrennt von den gesunden Zellen über einen filter. Die virus-Infektion konnte nicht übertragen werden—aber eine interferon-Antwort wurde auch beobachtet, in den nicht-infizierten Zellen.
Schließlich Experimente mit knock-out-Mäuse generiert, in Berlin fehlte der VRAC-Untereinheit LRRC8E sofern zwingende Beweise: Wenn die Nager wurden infiziert mit herpes-Viren, eine wesentlich höhere Viruslast und niedriger interferon-Freisetzung beobachtet wurden als in unveränderten kontrolltiere. „Das war genau das, was wir erwarten, da der Botenstoff nicht mehr übertragen werden, die aus infizierten Zellen zu benachbarten Zellen durch das fehlen des Kanals. Da diese übertragung der Regel stärkt die Immunantwort, die fehlende cGAMP-Transport VRAC reduziert die Abwehrmechanismen gegen solche Viren“, erläutert Professor Jentsch.
Neue Strategien gegen DNA-Viren und Krebs
Die Entdeckung dieser neuen Rolle der VRAC in der körpereigenen Abwehr gegen DNA-Viren, eine neue zusätzlich zu den vielen wichtigen Funktionen von VRAC, zieht noch mehr Aufmerksamkeit auf diesen Ionenkanal. Die Forscher gehen davon aus, dass VRAC könnte eine ähnliche Rolle spielen in der Krebstherapie. In der Tat, andere haben kürzlich nachgewiesen in Tierversuchen, dass cGAMP-transport von Krebszellen in benachbarte Wirtszellen verbesserte die Immunantwort gegen Tumoren—aber wie cGAMP transportiert hatte, blieb unklar.
Neben VRAC und gap junctions, einen Folat-transporter transportiert cGAMP über die Membran, wie gezeigt wurde, im letzten Jahr. Aber VRAC gefunden in weitere Zelltypen und daher spielt wahrscheinlich eine größere Rolle. In der Zukunft könnte es ein brauchbarer Ansatz zu aktivieren VRAC zur Verbesserung der Immunantwort. Möglichkeiten dazu wurden bereits beschrieben in das neue Werk.
