Patienten mit Parkinson-Krankheit haben Klumpen von α-synuklein (alpha-synuclein), manchmal bekannt als die „Parkinson-protein,“ im Gehirn gefunden. Diese zerstören die Zellmembranen, führte schließlich zum Zelltod. Nun, eine Methode entwickelt, die an der Chalmers University of Technology, Schweden, zeigt, wie die Zusammensetzung der Zellmembranen scheint ein entscheidender Faktor dafür, wie kleine Mengen von α-synuclein zu Schäden führen.
Parkinson-Krankheit ist eine unheilbare Zustand, in dem Neuronen, die Nervenzellen des Gehirns, die schrittweise abbauen und Gehirn-Funktionen werden gestört. Symptome können unfreiwillige schütteln des Körpers, und die Krankheit kann verursachen große leiden. Die Entwicklung von Medikamenten zu verlangsamen oder zu stoppen, die Krankheit, die Forscher versuchen zu verstehen, die molekularen Mechanismen dahinter, wie das α-synuclein trägt zur degeneration von Neuronen.
Es ist bekannt, dass Mitochondrien, der Energie produzierenden Kompartimente in Zellen, die beschädigt sind bei der Parkinson-Krankheit, die möglicherweise durch ‚amyloids‘ von α-synuclein. Amyloids sind Klumpen von Proteinen, angeordnet in langen Fasern mit einer gut geordneten Struktur, und Ihre Bildung unterliegt vielen neurodegenerativen Erkrankungen. Amyloids oder noch kleinere Klumpen von α-synuclein möglicherweise binden und zerstören mitochondrialen Membranen, aber die genauen Mechanismen sind noch unbekannt.
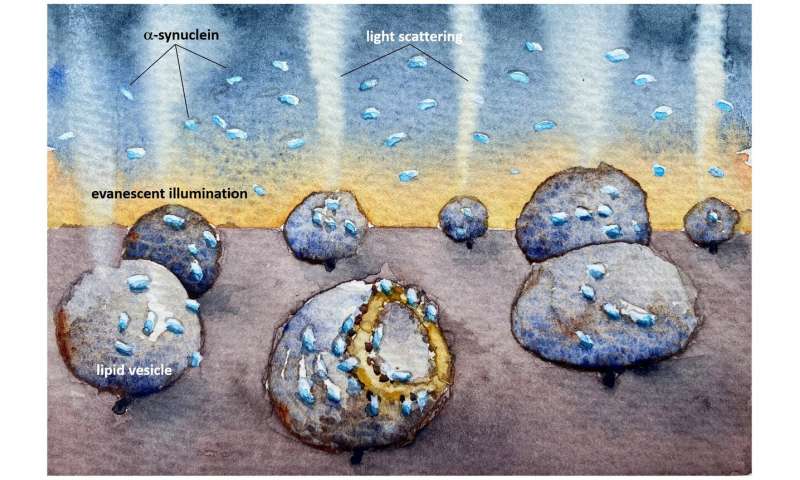
Die neue Studie, vor kurzem veröffentlicht in der Zeitschrift PNAS, konzentriert sich auf zwei Typen von Membran-ähnlichen Vesikeln, die Kapseln der Lipide, die verwendet werden können, wie ahmt der Membranen gefunden in den Zellen. Einer der Vesikel aus Lipiden, die sind oft in synaptischen Vesikeln, die andere enthält Lipide bezüglich der mitochondrialen Membranen.
Die Forscher fanden heraus, dass die Parkinson-protein binden würde sowohl Vesikel-Typen, aber nur verursacht strukturelle Veränderungen der mitochondrialen-wie Vesikel, die asymmetrisch verformt und leckte Ihre Inhalte.
„Nun, wir haben eine Methode entwickelt, die empfindlich genug, um zu beobachten, wie α-synuclein interagiert mit einzelnen Modell-Vesikel. In unserer Studie haben wir beobachtet, dass α-synuclein bindet, um—und zerstört—mitochondriale-wie Membranen, aber es gab keine Zerstörung der Membranen der synaptischen-wie Bläschen. Tritt der Schaden bei sehr niedrigen, nanomolaren Konzentration, wo das protein ist nur vorhanden, Monomere, nicht—aggregierten proteins. Solch niedrige protein-Konzentration wurde schwer Studie vor, aber die Reaktionen haben wir erkannt, jetzt könnte ein entscheidender Schritt im Verlauf der Krankheit“, sagt Pernilla Wittung-Stafshede, professor für Chemische Biologie an der Fakultät für Biologie und Biologische Engineering..
Die neue Methode der Forscher an der Chalmers University of Technology macht es möglich zu untersuchen, winzige Mengen von biologischen Molekülen ohne Hilfe von fluoreszierenden Markern. Dies ist ein großer Vorteil, wenn Sie Verfolgung natürlichen Reaktionen, da die Markierungen oft beeinflussen die Reaktionen, die Sie beobachten wollen, vor allem beim arbeiten mit kleinen Proteinen wie α-synuclein.
„Die chemischen Unterschiede zwischen den beiden Lipide verwendet werden, sind sehr klein, aber immer noch wir beobachteten dramatischen Unterschiede, wie α-synuclein beeinflusst die verschiedenen Vesikel“, sagt Pernilla Wittung-Stafshede.
„Wir glauben, dass die lipid-Chemie ist nicht der einzige bestimmende Faktor, aber auch, dass es makroskopische Unterschiede zwischen den beiden Membranen—wie die Dynamik und Interaktionen zwischen den Lipiden. Niemand hat sich wirklich genau angeschaut, was passiert an der Membran selbst, wenn das α-synuclein bindet es, und nie bei diesen niedrigen Konzentrationen.“
Der nächste Schritt für die Forscher ist es zu untersuchen, Varianten von der α-synuclein-protein mit Mutationen im Zusammenhang mit der Parkinson-Krankheit, und um zu untersuchen, lipid-Vesikeln, die mehr ähnlichkeit mit zellulären Membranen.
„Wir wollen auch zur Durchführung quantitativer Analysen, um zu verstehen, auf einer mechanistischen Ebene, wie die einzelnen Proteine sammeln sich auf der Oberfläche der Membran, die Schaden verursachen können“, sagt Fredrik Höök, professor an der Abteilung von Physik, die auch in der Forschung beteiligt.
