Ermittler an der Case Western Reserve University School of Medicine und University Hospitals Cleveland Medical Center entwickelt wurde der test für die Früherkennung des Barrett-ösophagus, bietet Versprechen für die Verhinderung der Todesfälle durch Speiseröhrenkrebs Adenokarzinom.
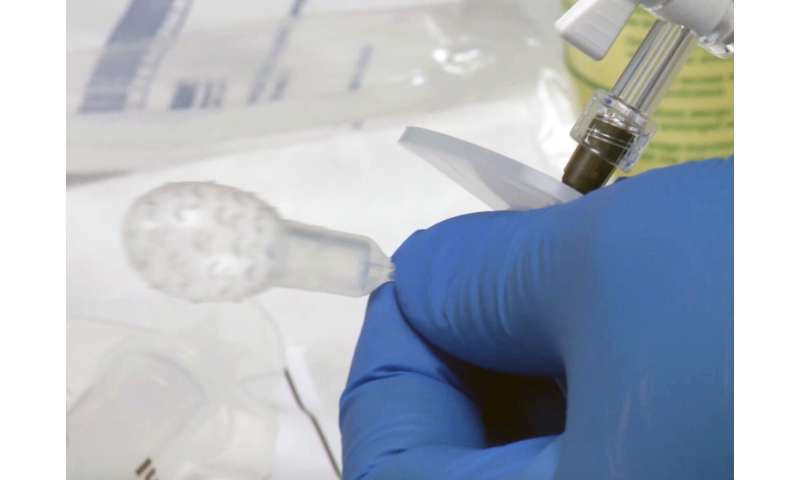
Der test beinhaltet eine neuartige verschluckbare Ballon-Gerät, das Proben in der Speiseröhre und ein DNA-assay, der erkennt, Barrett-ösophagus und ösophagus-Krebs. In einem großen Schritt zu bringen, diese Technologie nach vorne zu Patienten, die Ballon-Gerät hat soeben 510K von der US Food and Drug Administration (FDA) für die klinische Anwendung. Die jetzt FDA-gelöscht-Gerät wird hergestellt durch Luzide Diagnose und vermarktet unter der Handelsbezeichnung EsoCheck.
Barrett-ösophagus (BE) ist die Vorstufe Läsion von ösophagus-Adenokarzinom (EAC), eine höchst tödliche Krebs mit mehr als 80% der Sterblichkeit auf fünf Jahre. Tödliche EAC kann verhindert werden, wenn Patienten diagnostiziert werden, bei der Vorstufe des WERDEN, und schon früh Schwerpunkte in der Nähe von krebsartigen Veränderungen (Dysplasien) sind abgetragen. Doch der Nachweis von WERDEN traditionell erforderte der Endoskopie, eine teure und invasive test, der erfordert Sedierung und ist daher ungeeignet, da Sie eine Methode für die große screening.
In einem bedeutenden Schritt nach vorne, der Ermittler-team entwickelte eine einfache, fünf-minütigen ambulanten test, dass mehr als 90% empfindlich für die Erkennung von Individuen mit SICH. Patienten einfach schlucken eine Pille-sized Kapsel, befestigt an einem dünnen Silikon-Katheter. Nach der Lieferung an den Magen, der kleine Ballon im inneren der Kapsel, aufgeblasen wird, durch die Injektion von Luft durch den Katheter. Der aufgeblasene Ballon manövriert, Tupfer der unteren Speiseröhre in der Nähe des Magens, der region, wo WERDEN beginnt, und erhalten einer Probe von dem Futter-Zellen. Oberflächenstrukturen auf dem Ballon erhöht die Wirksamkeit der Probenahme. Der Ballon wird dann entlüftet durch den Katheter und invertiert zurück in die Kapsel und schützt damit die Speiseröhre Probe von Verdünnung oder Kontamination.
Nach der einfachen Abruf der Kapsel durch den Mund, DNA extrahiert aus der Ballon-Oberfläche und getestet für die aberrante DNA-Methylierung, die die Forscher entdeckt haben, ist die Diagnostik SEIN.
Das Gerät wurde von der School of Medicine der Fakultät und der Universitätskliniken ärzte Amitabh Chak, MD (Professor der Medizin und Leiter des NIH-Fall-Barrett-Ösophagus Translational-Research-Netzwerk „BETRNet“ – Programm), Joseph Willis, MD Professor der Pathologie und Pathologie der stellvertretende Vorsitzende für Klinische Angelegenheiten), und Sanford Markowitz, MD, Ph. D. (Ingalls Professor von Krebs-Genetik und Leiter des NIH-Case-GI-Cancers „SPORE“ Program of Research Excellence).
„Unser Ziel ist die Früherkennung“, sagte Chak. „Symptome des Barrett‘ s Speiseröhre, wie Sodbrennen, kann auch allgemein-gesehen in den Einzelpersonen, die Säure-reflux-Krankheit ohne SEIN. Diese Symptome können leicht behandelt werden, indem über den Ladentisch Medikamente so dass die Leute oft nicht getestet WERDEN, insbesondere durch eine invasive Tests wie Endoskopie. Als Ergebnis, wenn Individuen entwickeln, EAC, 95% der Zeit der Anwesenheit des vor Barrett-ösophagus war unentdeckt und unbekannt. Wir wollten eine einfachere, weniger teure test zu schaffen, die eine praktische Methode für das screening und die frühzeitige Erkennung von Personen mit, die kann dann genau beobachtet werden, um zu verhindern, dass die Entwicklung von EAC.“
„Darüber hinaus“, sagte Chak, „die FDA-Zulassung des EsoCheck Gerät bedeutet, das Gerät ist jetzt zur Verfügung, um Patienten und ärzten als nicht-endoskopische Methode für die Probenahme der Speiseröhre. Dadurch wird es viel leichter zu erkennen, Barrett-ösophagus im ambulanten setting.“
Unter Schirmherrschaft von der SPORE und BETRNet Programme, Chak führte eine klinische Studie, in denen 86 Personen wurden getestet, mit dem verschluckbare ösophagus-Ballon-Gerät. In der klinischen Studie, die Patienten vertragen die Ballon-test gut, mit 82% der Berichterstattung wenig bis gar keine Angst, Schmerzen oder ersticken, 93% Angabe, Sie würden wiederholen Sie den Vorgang erneut, und 95% Angabe, Sie würden empfehlen, den test zu anderen.
Helen Moinova, Ph. D., die Studie der erste Autor und Dozent an der School of Medicine, führte eine parallele Anstrengung innerhalb des Markowitz-Labor zur Identifizierung DNA-Veränderungen Diagnose von Barrett ‚ s. Mittels Genom-weiter Sequenzierung Ansätze, Moinova identifizierten zwei Gene, VIM und CCNA1, dass jeder sich chemisch modifiziert, indem die DNA-Methylierung in WERDEN.
„Mit zwei präzise Biomarker erhöht das Vertrauen in unsere Fähigkeit, richtig zu diagnostizieren Barrett-ösophagus“, sagte Moinova. „Zusammen genommen, unsere Ergebnisse zeigen, dass die nicht-endoskopische Ballon-sampling, gepaart mit molekularen tests für die methylierte VIM und CCNA1 Biomarker ist wirksam bei der Behandlung die Notwendigkeit für einfache, nicht-invasive, sichere und genaue Barrett-ösophagus, screening.“
Moinova DNA-methylierungs-test wurde mehr als 90% genau bei der Erkennung oder bei der Anerkennung einer Speiseröhre wie in einen normalen Satz von mehr als 300 Speiseröhre Endoskopie Proben von Chak ‚ s multizentrische BETRNet team.
Willis ist derzeit führenden Nationalen Institute der Gesundheit (NIH) unterstützt Anstrengungen zur Umsetzung der VIM und CCNA1-DNA-tests als standardisierte klinische Labor-Tests werden von der Universität Krankenhaus Pathologie Abteilung. Das team arbeitet auch mit Luziden Diagnose, um National bieten den VIM und CCNA1-DNA-assays für den Einsatz in Test-DNA von Patienten, die das EsoCheck Gerät.
