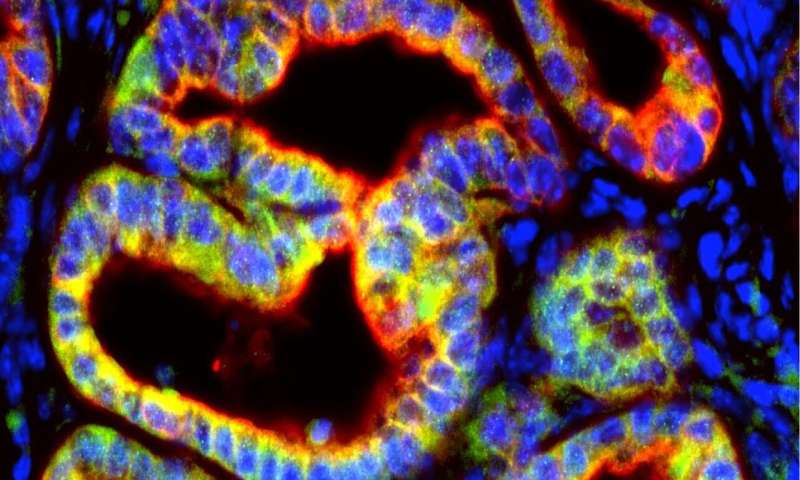
Ein Schlüssel immun-signal hat eine bislang unbekannte Rolle in turning off das Immunsystem den Angriff auf Pankreas-Krebs-Zellen, eine neue Studie findet.
Geführt durch Forscher an NYU Grossman School of Medicine, die Studie ergab, dass eine immune signaling protein, interleukin-1β (IL-1β), ist gemacht und veröffentlicht von der Pankreas-tumor-Zellen. Dies war angezeigt, um zu reduzieren, anti-Krebs-Immunantworten, die gefördert, das Wachstum des Pankreas duktale Adenokarzinom oder ein PDA, eine form von Krebs, ist in der Regel tödlich innerhalb von zwei Jahren.
Online veröffentlicht in Cancer Research, einer Zeitschrift der American Association for Cancer Research, am 8. Januar, fand die Studie heraus, dass die Blockierung der Wirkung von IL-1β in Mäusen, die mit immun-Proteine, so genannte Antikörper verursacht einen 32 Prozent Rückgang der PDA tumor Wachstum.
Andere Experimente kombiniert die anti-IL-1β Antikörper, die gloms auf und neutralisiert das Ziel, mit einer bereits zugelassenen Antikörper-Behandlung das Herunterfahren der protein – „checkpoint“ genannt PD1. Um Ersatzteile normalen Zellen aus immun-Angriff, das immune system verwendet „checkpoints“ auf Immunzellen, schalten Sie Sie aus, wenn Sie erhalten die richtigen Signale. Krebszellen hijack checkpoints, um das system auszuschalten, führt zu immun-suppression von CD8-T-Zellen, die sonst töten Krebszellen. Therapien genannten checkpoint-Inhibitoren, die diesem Effekt entgegenwirken.
Während wirksam gegen viele Krebsarten, checkpoint-Inhibitoren versagt haben, in PDA, die mit der response-rate in Tumoren so gering wie seit rund drei Prozent in einigen Studien und die Einschränkungen zurückzuführen auf schlechte CD8-T-Zell-infiltration und Immunsuppression. In der aktuellen Studie, die Zugabe von anti-IL-1β Antikörper anti-PD-1-Antikörper-Behandlung verdoppelt die infiltration von solchen T-Zellen in PDA Tumoren und erhöht die anti-tumor-Aktivität von PD-1-blockade von 40 Prozent.
„Durch die Konstruktion von Mäusen mit Versionen von PDA, die nicht die IL-1β-gen, fanden wir zum ersten mal, dass Bauchspeicheldrüsenkrebs Zellen produzieren IL-1β, und dass es wichtig ist für das weitere Wachstum des PDA-Tumoren,“ sagt Studie leitende Autor Dafna Bar-Sagi, Ph. D., Vizedekan für Wissenschaft und Chief Science Officer bei NYU Langone Health. „Die Blockierung von IL-1β mit einer Antikörper-Behandlung kann sind ein weiterer Weg, um die Pankreas-Tumoren anfällig für das Immunsystem, mit dem Potenzial zu erhöhen die Wirksamkeit von checkpoint-Inhibitoren kombiniert.“
Auslöser
Die neue Erkenntnis ist im Einklang mit der bisherigen Arbeit in anderen Labors, die beschrieben hatte, das mikrobiom, die Mischung der Bakterienarten in der Bauchspeicheldrüse, wie verändert die Anwesenheit von PDA, und ein Faktor in der Krebs-Wachstum. Das Gebiet hatte traditionell zugeordnet der Produktion von IL-1β auf Immunzellen, aber die neue Arbeit findet, die Pankreas-Tumorzellen können auch in Reaktion auf Proteine, die durch bestimmte Bakterien.
Bakterielle Produkte wurden gefunden, um Proteine aktivieren, die auf der Krebs-Zelle Oberflächen, sogenannte toll-like-Rezeptoren, die aus Kettenreaktionen, die erforderlich waren, für die IL-1β-Produktion in Krebszellen.
Das Forschungsteam fand auch, dass die höhere IL-1β-Produktion verursacht in der Nähe pankreatischen sternzellen, die Produktion zu steigern, von den dichten, Strukturproteine wie Kollagen. In desmoplasia ist die überwucherung von solchen Bindegewebe, das oft Auftritt, in der Nähe von Pankreas-Tumoren, und die im Zusammenhang mit der Behandlung Widerstand.
Aktive sternzellen wurden auch gefunden, um die trigger-Produktion der signalproteine locken Immunzellen, den Makrophagen in Tumoren und Programme, die Ihnen, den Typ (M2) unterdrückt Immunreaktionen. Experimente ebenfalls bestätigt, dass die höhere IL-1β-und M2-Makrophagen Ebenen, zusammen mit fibroblast-driven in desmoplasia, reduziert die Fähigkeit von Krebs-Zell-Tötung CD8-T-Zellen zu betreten Tumoren.
