Charcot-Marie-Tooth – (CMT) – Krankheit ist die häufigste form der angeborenen Neuropathien. Eine genetische mutation, die bewirkt, dass die isolierenden myelin-Schicht der peripheren Nerven zunehmend geschädigt, was zu schweren Behinderungen im Fall von CMT Typ 4B, zum Beispiel. Da die molekularen Grundlagen weitgehend unbekannt ist, diese Art von CMT ist nicht therapierbar und nicht heilbar bis zu diesem Tag. Jetzt Forscher vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) in Berlin, in Zusammenarbeit mit Kollegen aus Mailand, Paris und Mexiko, die in der Lage gewesen, um zu markieren eine neue molekulare Mechanismus: Nach Ihrer Entdeckung, das protein Rab35 und der mTOR-Signalweg reguliert spielen eine zentrale Rolle bei der Bildung von myelin Blattscheiden im peripheren Nervensystem. Erste in-vivo Experimente zeigen, dass neue Therapien abgeleitet werden kann aus den Ergebnissen. Das Werk wurde inzwischen veröffentlicht in der renommierten Zeitschrift Nature Communications.
Viele unserer Nervenstränge (Axone) sind umhüllt von einer Myelinscheide, die dafür sorgt, dass Signale gesendet werden können, in der Nähe, die sofort vom Gehirn zu Muskeln und Organen. Allerdings genetisch programmierte Mängel, die in myelination auftreten, unter den breiten Gruppe von erworbenen Neuropathien, wobei diese Signalisierung Prozess. Dies resultiert in der Entstehung einer Vielzahl von neurologischen Defizite auftreten, in peripheren Nerven und der degeneration der Nervenstränge. Dies ist der Fall mit der Charcot-Marie-Tooth-Krankheit (CMT), die häufigste vererbte Neuropathie. CMT Typ 4B zeichnet sich durch einen sehr frühen Beginn der Krankheit; betroffene sind oft schon im Rollstuhl im Teenageralter. Im schlimmsten Fall, neurodegeneration breitet sich auf die Atemwege, die führen zum Tod durch Atemstillstand. Derzeit gibt es keine Aussicht auf eine Heilung.
Unerwartete Interaktion Partner
Es ist daher umso wichtiger, erkunden Sie die weitgehend unbekannten molekularen Mechanismen der Krankheit. Das ist genau das, was die Wissenschaftler vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) in Berlin getan haben, in Zusammenarbeit mit den teams von Forschern, geführt von Professor Alessandra Bolino (IRCCS Ospedale San Raffaele Universität, Mailand), Professor Arnaud Echard (Université Sorbonne / Institut Pasteur, Paris) und Professor Genaro Patiño-López (Hospital Infantil, Mexiko).
Die Erforschung der protein-Rab35, das Berliner team unter der Leitung von Linda Sawade und Professor Volker Haucke, entdeckte mehr oder weniger durch Zufall, dass diese kleine GTPase, die an der regulation der intrazellulären membrantransport, interagiert mit drei Proteine, die mit CMT-4B: durch eine gen-mutation, MTMR2, MTMR5 und MTMR13 nicht richtig funktionieren CMT-4B-Patienten, oder Sie sind komplett fehlt.
Diese drei wichtigen Proteine gehören zu der Gruppe der myotubularin-related (MTMR) phosphatidylinositol (PI) – Phosphatasen, die spezifisch hydrolysieren die endosomal-Signalisierung Lipide PI(3)P und PI(3,5)P2 an der 3′-Phosphat-Gruppe, d.h. Sie entfernen von Phosphaten aus Lipiden.
Rab35 regelt myelin sheath formation
„Unsere Studie ergab, dass das protein Rab35 reguliert das Längenwachstum der myelinscheiden durch die Bindung und Rekrutierung der zwei pseudophosphatases MTMR13 und MTMR5, und damit auch die aktive phosphatase MTMR2 gebunden, um es in einer komplexen,“ berichtet Linda Sawade, Blei-Autor der Studie.
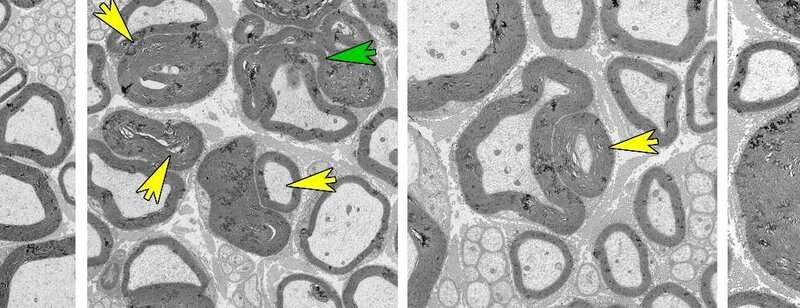
Die neue Erkenntnis war, dass Rab35 bindet lipid-phosphatase-Komplex und spielt daher eine wichtige Rolle bei der Regulierung myelin sheath formation. Die Detektion wurde bestätigt in knock-out-micethat insbesondere fehlen die Rab35 protein in Schwann-Zellen—die Zellen im peripheren Nervensystem bilden myelin Blattscheiden. Verlust der Rab35-protein führte zu den Anomalien und, schließlich, die degenerative Zerstörung (demyelinisierung) von myelin Blattscheiden in den Ischiasnerv.
Hemmung von mTORC1 als wirksam erweist
Zufällig beobachteten die Forscher eine abnorm erhöhte Aktivität des mTORC1-Signalwegs– eine der zentralen signaling-komplexe für die Regulierung der Myelinscheide Bildung im Nervengewebe. Pharmakologische Hemmung des hyperaktiven mTORC1-signaling-Komplex mit dem Medikament Rapamycin teilweise gerettet Nervenschäden in knock-out-Mäuse. Weitere Experimente an kultivierten Zellen, in denen Rab35 Ausdruck unterdrückt worden waren, bestätigte die positiven Effekte der mTORC1-Hemmung auf Defekten myelin Blattscheiden.
Zudem konnten die Forscher ziehen eine wichtige Schlussfolgerung aus der Abwesenheit des Rab35 protein: mTORC1 ist hyperaktiv, da PI-3-Phosphate werden nicht mehr geregelt, wodurch die Akkumulation von PI(3)P und PI(3,5)P2 Lipide. „Wir gehen davon aus, dass dieser krankhafte Prozess führt von einer Beeinträchtigung der Rekrutierung von MTMR-komplexe“, erklärt der Biochemiker und Zellbiologe Linda Sawade. „Umgekehrt würde dies bedeuten, dass Rab35 normalerweise unterdrückt die Aktivität von mTORC1 durch die Rekrutierung von MTMR-Phosphatasen zu den Lysosomen.“
Ergebnisse haben Auswirkungen über die Grundlagenforschung
Kurz, die Ergebnisse haben eine große Bedeutung für die Grundlagenforschung: Rab35 ist eine bislang unbekannte regulator von myelin sheath formation in das periphere Nervensystem und ein repressor von mTORC1.
Die Ergebnisse bieten auch einen Schimmer von Hoffnung zu CMT4B Patienten: Therapeutische Behandlung mit mTORC1-Hemmung der Medikamente wie Rapamycin könnte sich verbessern, die progression der Krankheit. Es wäre die erste option bei der Behandlung für eine ernsthafte Erkrankung sein.
